
20
DENK(T)RÄUME
Mobilität
Band 5: Chemie und Sport
z. B. zur Behandlung der Blutarmut von Dialysepa-
tienten, wird aber in zunehmendem – geradezu er-
schreckendem – Maße als Dopingmittel missbraucht.
Nachweis von rEPO
Bis zum Jahr 2000 konnte menschliches hEPO nicht
von genetisch hergestelltem, rekombinatem rEPO un-
terschieden werden. Doch dann wurde ein Testverfah-
ren zur Differenzierung der beiden Stoffe entwickelt.
13
Die beiden EPO-Moleküle haben nämlich eine et-
was andere Zuckersubstitution: Beim rekombinanten
rEPO ist der Baustein Neuraminsäure zu etwa 95%
am Stickstoff acetyliert (= Sialinsäure), während die
Neuraminsäure im menschlichen hEPO bevorzugt
nicht acetyliert vorliegt (s. Abb. 10).
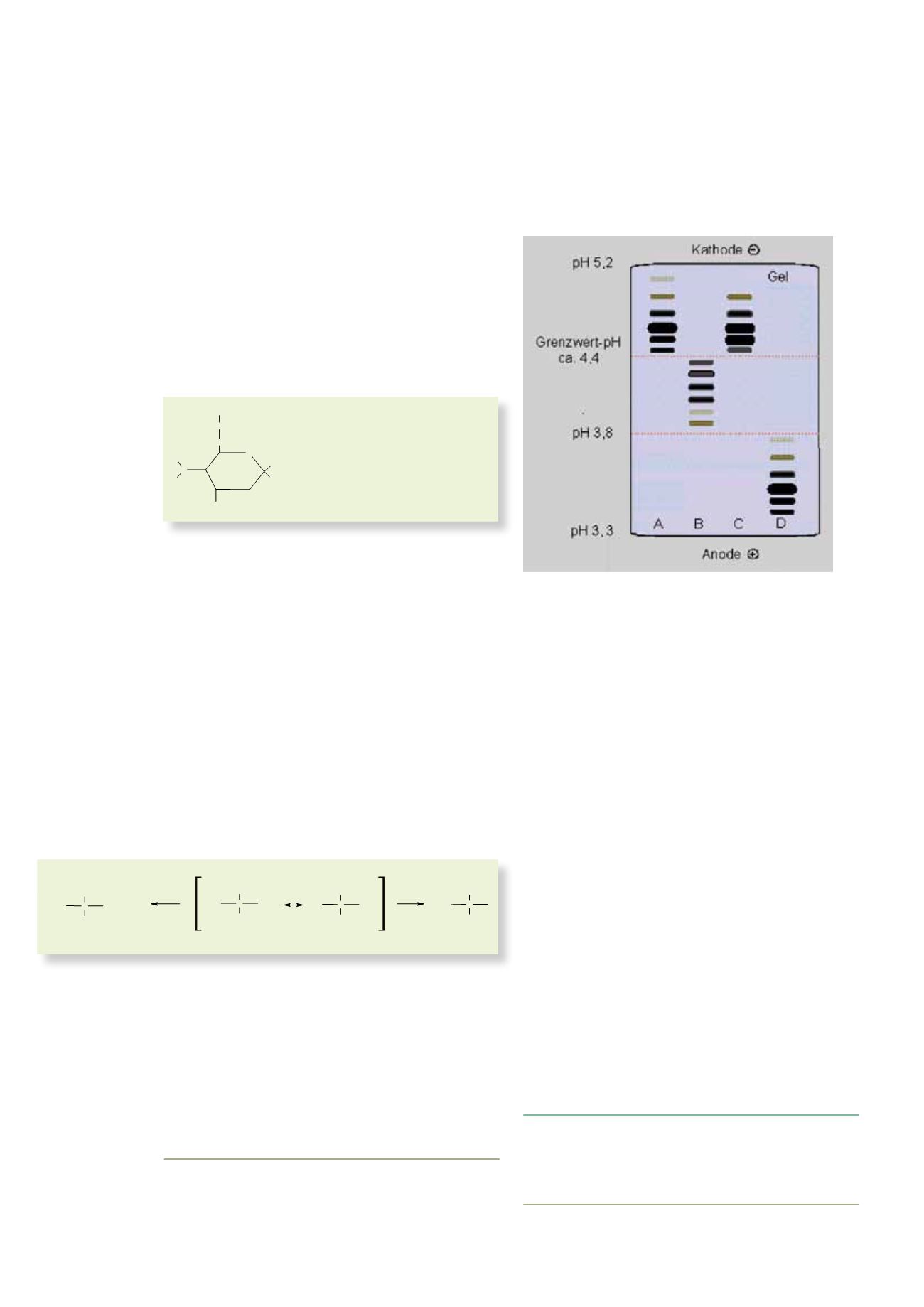
Bei dem neuen Testverfahren werden die Proteine im
Urin durch isoelektrische Fokussierung (IEF), ein spe-
zielles elektrophoretisches Analyseverfahren, getrennt
und nachgewiesen. Dabei nutzt man ihre unterschied-
lichen isoelektrischen Punkte aus.
Einen isoelektrischen Punkt haben Moleküle, die
gleichzeitig basische und saure Gruppen besitzen, also
auch die Aminosäuren und Proteine. In Abhängigkeit
vom pH-Wert liegt eine Aminosäure in verschiedenen
Formen vor. Am isoelektrischen Punkt ist sie ein Zwit-
terion. Dieses besitzt zwar Ladungen, ist aber in der
Summe elektrisch neutral (s. Abb. 11). Bei welchem
pH-Wert der isoelektrische Punkt vorliegt, hängt von
den elektronischen Eigenschaften des Aminosäure-
Substituenten (R) ab.
Ähnlich wie bei einer Aminosäure ist der isoelektrische
Punkt eines Proteins auch maßgeblich von dessen
Substituenten, beim EPO insbesondere von den Zu-
ckerresten, abhängig.
Bei der isoelektrischen Fokussierung wird auf einem
Gel ein pH-Gradient erzeugt. Das aufgetragene Protein
wandert, bis der pH-Wert dem isoelektrischen Punkt
des Proteins entspricht (pH = IEP). Dann bewegt sich
13 F. Lasne, J. de Ceaurriz: Recombinant erythropoietin in urine. In: Nature 408,
2000, S. 635. Sowie: C. H. Hokke, M. J. H. Roosenboom, J. E. Thomas-Oates, J.
P. Kamerling, J. F. G. Vliegenthart: Structure determination of the disilylated
poly-(N-acetyllactosamine)-containing O-linked carbohydrate chains of
equine chorionic gonadotropin. In: Glycoconjugate J. 11, 1994, S. 35-41
das Molekül im elektrischen Feld nicht mehr weiter,
weil seine Nettoladung 0 ist. So können hEPO und
rEPO voneinander getrennt werden, weil ihre unglei-
chen Seitenketten ihre verschiedenen isoelektrischen
Punkte verursachen. Es folgen die Reinigung durch ei-
nen Immunoblot sowie die Sichtbarmachung durch
Chemolumineszenz (s. Abb. 12).
Neue EPO-Varianten durch Gendoping
Die Herstellung von EPO-Varianten durch genetisch
veränderte Säugetierzellen zeigt, wie sich das Gen-
doping als neue Form des Dopings entwickelt. Seit
2001 ist ein weiteres EPO-Derivat, Darbepoetin NESP
(Novel Erythropoiesis Stimulating Protein), bekannt.
Es unterscheidet sich durch fünf Aminosäuren und
durch zusätzliche Zucker-Seitenketten vom hEPO
14
und wirkt nach einer intravenösen Injektion deutlich
länger als letzteres, was sich der Betrüger natürlich
wünscht. (Die Halbwertszeit von Darbepoetin NESP
beträgt 21 Stunden, die von hEPO nur 8,5 Stunden.)
Doch die Dopingfahnder können ihm mittlerweile
auf die Schliche kommen. Die Abbildung 12 zeigt die
Chromatogramme von hEPO, rEPO und Darbepoe-
tin im Vergleich.
Welche Dopingsubstanz ist jetzt schon im Einsatz,
kann aber noch nicht nachgewiesen werden? Der
vorliegende Artikel kann in Kürze bestimmt weiter
geschrieben werden – so traurig es ist.
n
Ü b e r d i e A u t o r e n
Volker Wiskamp
Martin Hilfeld
((Platz freihalten))
14 Darbepoetin alfa (NESP, Novel Erythropoiesis Stimulating Protein,
Aranesp
®
), hergestellt von der Firma Amgen
Abb. 10: Derivate
des EPO-Bausteins
Neuraminsäure
Abb. 12: Ergebnis der isoelektrischen Fokussierung von hEPO (B), rEPO (A),
rEPO aus einer positiven Dopingprobe (C) sowie Darbepoetin (D) Quelle:
Institut für Biochemie der Deutschen Sporthochschule Köln
Abb. 11: Eine Amino-
säure bei verschie-
denen pH-Werten
N
O
OH
OH
OH
CH
2
OH
CH
2
OH
CH
2
OH
H
R
R = H
Neuraminsäure
R = COCH
3
N-Acetylneuraminsäure (Sialinsäure)
R = COCH
2
OH
N-Glycolylneuraminsäure
NH
3
+
C COOH
H
R
NH
2
C COOH
H
R
NH
3
+
C COO
-
H
R
NH
2
C COO
-
H
R
in saurem
Medium
in basischem
Medium
Aminosäure
Aminosäure als Zwitterion


















