
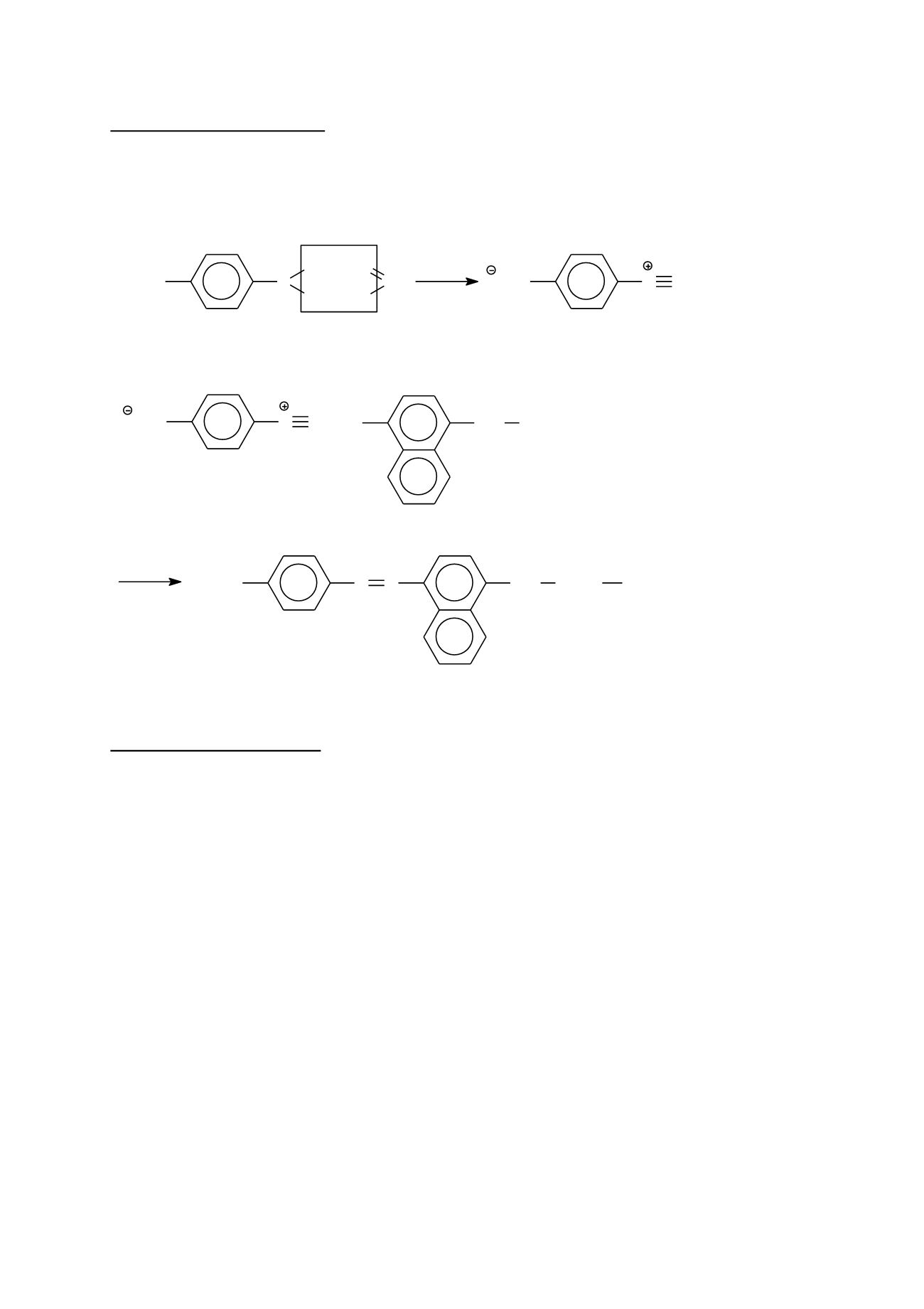
Nachweis von Nitrat-Ionen
Nitrat wird durch naszierenden Wasserstoff, welcher aus Zink und Essigsäure entsteht, zu
Nitrit reduziert. Dies reagiert mit Grieß-Reagenz, es entsteht ein rotvioletter Azofarbstoff
Zn + 2 H
+
→ Zn
2+
+ 2H
NO
3
-
+ 2 H → NO
2
-
+ H
2
O
HO
3
S
N
H
H
O
N
HO
HOS
N N
4-Azobenzolsulfonsäure
HOS
N N H
HN
2
(CH
2
)
2
x 2 HCl
+
N-(1-Naphthyl)-ethylen-
diammoniumchlorid
HO
3
S
N N
NH
2
(CH
2
)
2
NH
2
x 2 HCl
violettroter Azofarbstoff
Nachweis von Nitrit-Ionen
Methode 1:Oxidation von Iodid zu Iod
Nitrit-Ionen oxidieren in phosphorsaurer Lösung Iodid-Ionen zu elementarem Iod,
welches mit Stärke einen blauen Farbkomplex bildet.
2 HNO
2
+ 2 HI → I
2
+ 2 NO + 2 H
2
O
Methode 2: Bildung von Nitroso-Eisen(II)-Sulfat
Eisen(II)-Ionen werden durch Nitrit in saurer Lösung zu Eisen(III)-Ionen oxidiert. Das
gebildete Stichstoffmonoxid bildet mit überschüssigen Eisen(II)-Sulfat einen braunen
Farbkomplex von Nitroso-Eisen(II)-Sulfat.
Fe
2+
+ NO
2
-
+ 2 H
+
→ Fe
3+
+ NO + H
2
O
Fe
3+
+ 3 NO → [Fe(NO)]
2+
Methode 3: Reduktion von Kaliumpermanganat
Nitrit wird in saurer Lösung durch Kaliumpermanganat zum Nitrat oxidiert, während das
Permanganat zum zweiwertigen Mangan-Ion reduziert wird. Das Ergebnis ist an der
Entfärbung von Permanganat erkennbar.
2 MnO
4
-
+ 5 NO
2
-
+ 6 H
+
→ 2 Mn
2+
+ 5 NO
3
-
+ 3 H
2
O
Methode 4: Bildung eines Azofarbstoffes
Nitrit reagiert in essigsaurer Lösung mit Griess-Reagenz direkt, es entsteht ein rotvioletter
Azofarbstoff (siehe Nitrat).


















